اسید کلریدریک
اسید کلریدریک معرفی محصول و مشخصات
اسید کلریدریک (HCl) محصول جانبی واحد SOP طرح بوده و بخشی از آن بعنوان ماده اولیه در تولید پلیآلومینیوم کلراید در واحد SOP مصرف میگردد.
بطور کلی اسید HCl به دو صورت کلرید هیدروژن آبدار یا اسید HCl آبی در غلظت ها و خلوص مختلف به فروش میرسد. تفاوت این دو نوع اسید در آن است که کلرید هیدروژن آبدار به خاطر ارزش کلر و اسید کلریدریک آبی بخاطر ارزش آن بعنوان اسید قوی غیر اکسیدکننده کاربرد دارد. حمل و نقل HCl آبدار بصورت خط لوله و یا گاز فشرده (مایع شده) در کپسول میباشد. HCl آبدار به شدت فرار است. این واده دارای نقطه جوش اتمسفریک °C85- است. انبار کردن آن مستلزم سرد کردن مواد تا °C 12- و فشردن آن تا فشار ۷۰۰ پوند است. HCl تجاری متداول محلولهای اسیدی به ترتیب دارای ۳۱% و ۳۵% HCl محلول در آب میباشد.
جدول زیر خواص فیزیکی و شیمیایی اسید کلریدریک را نشان میدهد:
خواص فیزیکی و شیمیایی اسید کلریدریک
| خواص فیزیکی | واحد | مقدار |
| وزن ملکولی | – | ۵/۳۶ |
| نقطه ذوب | °C | ۴/۱۱۴- |
| نقطه جوش | °C | ۸۵- |
| دانسیته بخار | gr/lit | ۶۳۹/۱ |
| دانسیته مایع | gr/cm۳ | ۱۸۷/۱ |
| دانسیته ویژه | – | ۱۹/۱ |
اسید کلریدریک یک محصول منطقهای است. نوع تجارتی دارای دو سوم آب بوده و هزینه های فروش و حمل و نگهداری را بالا میبرد، حتی اگر فاصله تا محل تولید نسبتاً کوتاه باشد، موارد مصرف ویژه بسته به منطقه تغییر میکند.
کیفیت اسید بر اساس غلظت و خلوص آن تعیین میشود. در فرایند تولید ایزو سیانات، اسید کلریدریک با کیفیت بالا تولید میشود که در صنایع براحتی قابل استفاده است.
در حالیکه HCl تولیدی از فرایند فلوئوروکربن، ناخالص است. اگر HCl کیفیت مناسب و بالایی نداشته باشد میتوان از آن در تولید کلرور سدیم استفاده نمود.
کاربردهای اسید کلریدریک
بخش عمده مصرف اسید کلریدریک جهت تولید مواد غیر شیمیایی برای فراوری آب نمک، اسید شویی فولاد، صنایع غذایی و اسیدی کردن چاههای نفت و … است.
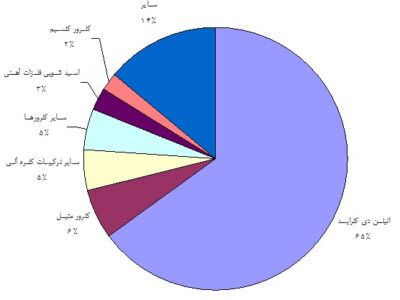
اسید کلریدریک در تولید اتیلن دی کلراید، کلرور متیل، کلرور سدیم، کلرور کلسیم و در تولید برخی مواد آلی و غیر آلی مورد استفاده قرار میگیرد. متوسط الگوی مصرف جهانی اسید HCl در نمودار زیر نشان داده شده است.
متوسط الگوی مصرف جهانی اسید HCl
الف) اتیلن دی کلراید
در فرایند اکسی کلریناسیون اتیلن و اسید کلریدریک، اتیلن دی کلراید تهیه میشود. عمده ترین مصرف این ماده، تهیه مونومر وینیل کلراید میباشد و حدود ۹۵% از اتیلن دی کلراید مصرفی جهان در تهیه وینیل کلراید مورد استفاده قرار میگیرد. همچنین مخلوط اتیلن آمینها از
واکنش اتیلن دی کلراید با آمونیاک بدست می آید. از اتیلن دی کلراید در تولید کلرو اتان نیز استفاده می شود. این حلال شامل ۱ و ۱ و ۱- تری کلرو اتان، تری کلرو اتیلن و پر کلرواتیلن میباشد.
ب) کلرور متیل
در یکی از فرایندهای تولید کلرور متیل، از اسید کلریدریک استفاده میشود. کلرور متیل هم بصورت ماده نهایی و هم بصورت ماده واسطه دارای کاربردهای متعددی است. امروزه حدود ۹۰% کلرور متیل در تولید متیل کلروسیلانها که ماده واسطه تولید سیلیکونها هستند بکار میرود
ج) اسید شویی (تمیزکاری) فلزات آهنی
اسید کلریدریک بعنوان یک اسید قوی در تمیزکاری فلزات و بالاخص فولاد بکار میرود. دلایل استفاده از اسید کلریدریک در اسید شویی فلزات آهنی عبارتست از:
– قابلیت بازیابی اسید کلریدریک
– سرعت بالای اسید شویی
– میزان کمتر اسید مصرفی
– کیفیت بالای اسیدشویی
عمده ترین مصرف HCl در این زمینه از مصرف، در اسید شویی مستمر ورقهای فولاد است. ۹۰% از این بازار را به خود اختصاص داده است و جایگزین اسید سولفوریک شده است.
د) سایر موارد
استفاده در فرایندهای نفت و گاز، اسیدی کردن سنگ آهک یا تشکیل دولومیت و تهیه آب بدون یون از جمله سایر مصارف اسید کلریدریک میباشند. همچنین این محصول در بخش معدن در تولید فلزات اورانیوم، تنگستن و منیزیم به کار میرود. بازارهای مصرف مصرف متنوع دیگری نیز برای HCl بدلیل در دسترس بودن، قیمت پایین و کاربرد آن وجود دارد. بعنوان مثال مصرف عمده این ماده در ایران در شستشوی سرویسهای بهداشتی و کاشی در منازل است که با عنوان جوهر نمک مورد مصرف قرار میگیرد.
از دیگر موارد مصرف این اسید، تولید مواد شیمیایی، مواد داروئی و محصولات بهداشتی است.
محصول جایگزین
در برخی از فرایندها، اسید کلریدریک با گاز کلر و اسید سولفوریک قابل جایگزینی است. برای مثال در اسیدشویی فولاد اگرچه از اسید سولفوریک هم میتوان استفاده نمود. معهذا با توجه به افزایش هزینه های عملیاتی و نیز مسائل زیست محیطی مربوط به استفاده از اسید سولفوریک، بهتر است از اسید کلریدریک استفاده شود.
تنها رقیب جدی و اصلی اسید کلریدریک بعنوان یک اسید قوی، اسید سولفوریک است. البته در فرایندهای شیمیایی که از این ماده بعنوان یک ماده شیمیایی یا واکنش دهنده استفاده میشود، جایگزینی برای آن نمیتوان متصور شد.